

TOC:
氨基丙二酸(Aminomalonate, Ama)是谷氨酸和天冬氨酸的同系物,也是自然界广泛存在的一种代谢物或结构单元。Ama被发现存在于多种天然产物,同时,也作为延伸单元参与多种非核糖体肽/聚酮天然产物的生物合成。Ama还被发现大量存在于细菌蛋白质组的碱水解液中,猜测Ama可以通过某种翻译后修饰的方式产生,然而这样一种核糖体途径迄今未知。
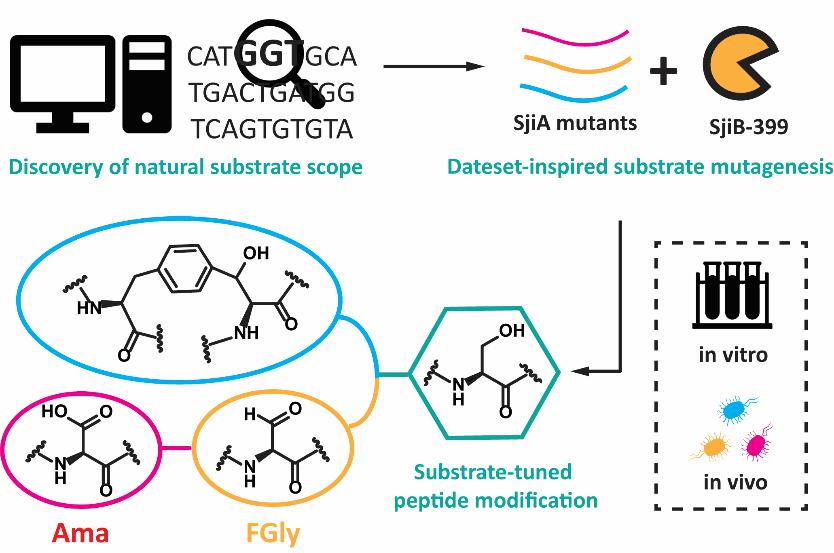
核糖体合成翻译后修饰的多肽类天然产物(RiPPs)为发现全新的多肽生物化学提供了机会。其中S-腺苷甲硫氨酸自由基酶(rSAM)是一类存在于多种RiPPs家族的后修饰酶,并参与催化了诸如C-C, C-O, C-S键形成等多种化学上较为困难的反应。在这些反应中,rSAM酶首先利用一个保守的[4Fe-4S]簇去还原均裂辅因子S-腺苷甲硫氨酸(SAM),产生一个高度活泼的5’-脱氧腺苷(dAdo)自由基攫取底物氢原子,从而引发后续的反应。近日,复旦大学张琪课题组对一类新发现的RiPP修饰rSAM酶,即三残基环番成熟酶(3-CyFE),进行了详尽的体内体外酶学实验鉴定,报道了此类酶具有高度的催化泛杂性,不仅能够催化底物FxS形成三残基环番,也能催化Ser氧化经中间体甲醛甘氨酸(FGly)形成Ama,阐明了Ama合成的第一种核糖体途径。
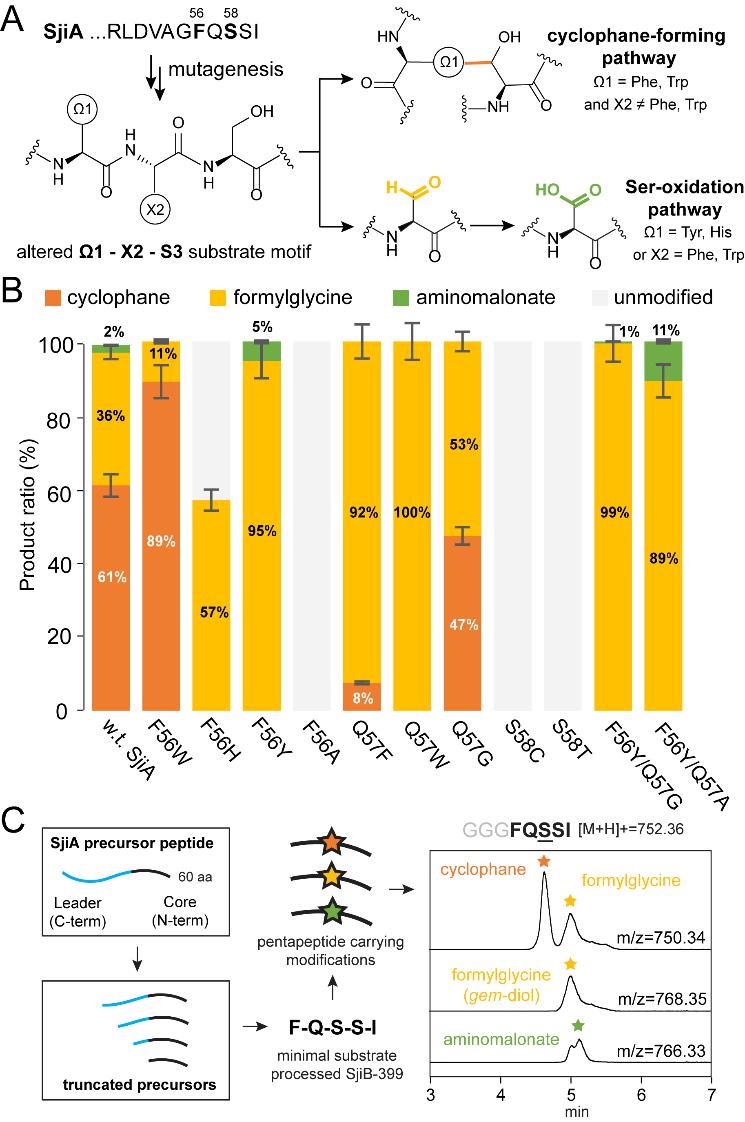
作者又通过体内共表达实验探索了3-CyFE的底物谱,发现了此类酶的两个特性:1)环番形成途径和Ser氧化途径可以被分配给不同的底物序列,2)催化反应是前导肽不依赖的,这样的两个发现为后续多肽和蛋白的结构衍生来实现化学多样性奠定了基础。
本研究以“Post-Translational Formation of Aminomalonate by a Promiscuous Peptide-Modifying Radical SAM Enzyme”为题在线发表于《德国应用化学》(Angew. Chem. Int. Ed.),并被评选为“hot paper”。本文第一作者为复旦大学化学系19级直博生马溯泽和19级硕士生陈恒,通讯作者为复旦大学化学系张琪教授。该工作得到国家自然科学基金委项目和国家重点研发项目的支持。
全文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202107192





