

不对称Diels–Alder(DA)反应是构建手性六碳环的重要方法。目前的研究主要集中于不对称正电子需求的DA反应。与此相反,不对称反电子需求的全碳DA反应则研究极少。从合成的角度来看,不对称反电子需求的DA反应可以为六碳环的合成提供了一种与正电子需求的反应完全不同的断键方式,因此有望在一些含有特定结构的天然产物和药物分子的合成中得到精准的应用。
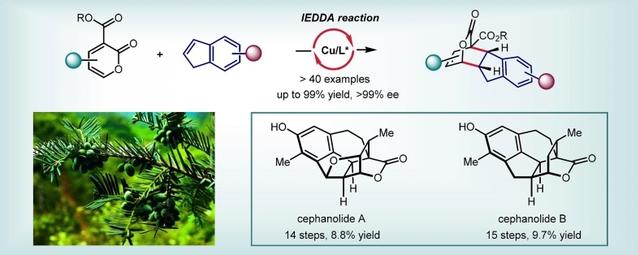
近日,我系蔡泉课题组发展了一种二价铜和手性噁唑啉配体催化的3-酯基-2-吡喃酮与茚的反电子需求全碳DA反应,以一种通用的方法一步对映选择性构建含有多个手性中心和官能团的手性氢化芴结构。在该反应中,茚上的取代基除了给电子基团,还能容忍各种中性甚至吸电子基团,从而极大拓展了反电子需求全碳DA反应亲双烯体的范围,有利于该方法在实际合成中的应用。基于此,他们分别以14步和8.8%的总产率,以及15步和9.7%的总产率实现了三尖杉降二萜天然产物cephanolide A和cephanolide B的不对称全合成。值得指出的是,这是到目前为止这类天然产物分子最简短和高效的不对称合成路线。
这一研究成果以“Catalytic Asymmetric Inverse-Electron-Demand Diels–Alder Reactions of 2-Pyrones with Indenes: Total Syntheses of Cephanolides A and B”为题发表在《德国应用化学》杂志(Angew. Chem. Int. Ed. 2021, 60, 26610–26615)。化学系直博生鲁杨为本论文的第一作者,青年研究员蔡泉为通讯作者。该工作得到了国家自然科学基金和复旦大学启动基金的资助。
全文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202112223





