

Diels−Alder反应于1928年首次报道,并于1950年获得诺贝尔化学奖,是有机合成化学中最重要的反应之一。传统的Diels−Alder反应发生在共轭二烯与烯烃之间,是合成六碳环的重要方法。然而,两种不同共轭二烯之间的交叉Diels−Alder反应由于周环选择性(periselectivity)的问题,会同时发生正电子需求和反电子需求的Diels−Alder反应,且区域选择性、立体选择性也往往较差,大大限制了其在合成中的应用。从合成的角度上看,若交叉Diels−Alder反应的周环选择性、区域选择性和立体选择性等一系列问题能得以克服,那么它将成为传统Diels−Alder反应的重要补充。然而,选择性的交叉Diels−Alder反应十分具有挑战性,是目前Diels−Alder反应研究领域的一个难点问题。
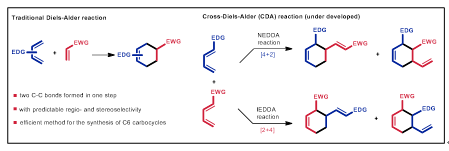
图1:传统Diels−Alder反应与交叉Diels−Alder反应
复旦大学化学系蔡泉青年研究员团队自2017年建立课题组以来,一直致力于利用2-吡喃酮这种特殊的双烯体发展不对称反电子需求的全碳Diels−Alder反应。近期,该团队与来自加州大学洛杉矶分校、杭州师范大学的合作者在《自然•催化》(Nature Catalysis)在线发表了题为“具有‘两可’反应模式的不对称交叉Diels−Alder反应及合成应用(An enantioselective ambimodal cross-Diels−Alder reaction and applications in synthesis)”的研究论文。
在该项研究中,蔡泉研究团队利用2-吡喃酮与非活化1,3-共轭二烯发展了一种罕见的具有‘两可’反应模式的不对称交叉Diels−Alder反应。在二价铜和手性噁唑啉配体的催化下,3-酯基-2-吡喃酮与多种取代的环戊二烯、环己二烯、富烯能发生高周环选择性、高对映选择性的不对称交叉Diels−Alder反应,发散性地合成系列六元环外带有额外双键的顺式并环结构。这种重要结构的合成过去需要通过Diels−Alder反应、1, 2-加成、3, 3-sigma重排等多步反应才能实现,且反应条件通常较为剧烈。利用该方法,研究者通过选择合适的环状共轭二烯底物,在温和的反应条件下生成高度官能团化的关键手性中间体,从而以简短的合成路线分别实现了抗疟药物青蒿素和植物生长调节剂冠菌素的高效形式不对称全合成,为这些重要活性分子的结构改造提供方法学和合成路线基础。

图2:不对称交叉Diels−Alder反应
为了理解该对称交叉Diels−Alder反应的周环选择性和对映选择性调控机制,蔡泉研究组与加州大学洛杉矶分校的理论计算化学家K. N. Houk教授、加州大学洛杉矶分校/杭州师范大学的杨丽敏副教授合作,通过对照实验和密度泛函理论计算的手段研究了反应的历程和机理。研究的结果表明,该反应具有一种特殊的“两可”反应模式,即:反应经历一种ambimodal过渡态(“两可”过渡态),同时得到 [4+2](正电子需求)和[2+4](反电子需求)的环加成产物。由于这两种产物的形成经过了相同的过渡态,因此它们具有相同的绝对构型和ee值。随后,这两种环加成产物通过Cope重排反应过渡态相互转化,最终得到热力学稳定的反电子需求的环加成产物。
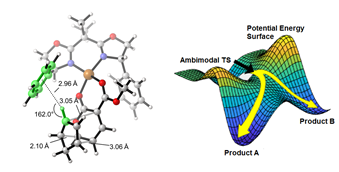
图3:“两可”反应过渡态(ambimodal transition state)
该研究发展了一种具有新型反应模式的Diels−Alder反应,不仅为手性双环结构和含有此类结构的生物活性分子的合成提供新途径和新方法,同时也对理解周环反应的选择性调控机制具有启发意义。化学系的博士研究生徐萌萌和杭州师范大学的杨丽敏副教授为本论文的第一作者,我系青年研究员蔡泉和加州大学洛杉矶分校的K. N. Houk教授为共同通讯作者。该工作得到了国家自然科学基金和复旦大学启动基金的资助。
全文链接:https://www.nature.com/articles/s41929-021-00687-x





