

近日,复旦大学化学系胡可青年研究员及合作成员受自然界中天然光酶(DNA光裂合酶)修复受损伤DNA机制的启发,提出光催化剂逐次累积红光光子能量以达到高能激发态的策略,实现红光催化裂解偶氮键,并成功应用于乏氧细胞内的红光生物正交偶氮前药激活。该研究成果以“Nature-Inspired Photocatalytic Azo Bond Cleavage with Red Light”为题于2023年12月11日在线发表于《美国化学会会志》(J. Am. Chem. Soc.)。复旦大学化学系2019级直博生赵子建为论文第一作者,胡可青年研究员为论文通讯作者。
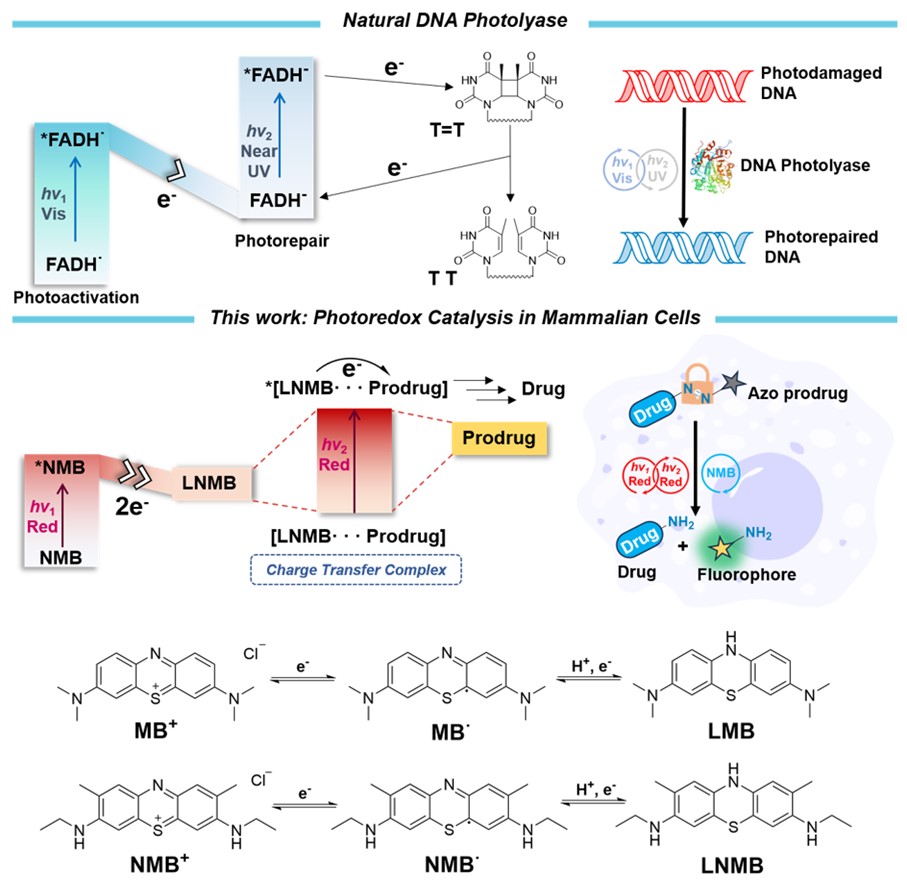
图1. 天然光酶启发的红光催化偶氮键裂解及光催化剂结构。图片来源:J. Am. Chem. Soc.
光催化氧化还原反应为调节细胞内多种多样的生理过程提供了一类强有力的工具。偶氮键作为一种独特、稳定的N=N双键,其选择性裂解在前药激活、乏氧检测及响应、适体及抗体识别以及基因调控等领域有着重要应用。此外,由于偶氮键固有的可双侧连接的特性,即可以作为识别保护基团连接两个不同功能的分子,其在生物正交断键反应中也有着巨大潜力。然而,由于偶氮键键能较大(418 kJ/mol),且完全断裂需要4电子/质子协同,理论上直接裂解偶氮键需要波长小于563nm的高能量光子。实际上,由于偶氮化合物激发态通常具有较快的非辐射跃迁途径,即便是在能量更高的蓝光甚至紫外光激发下也很难直接打断偶氮键。因此,如何在生物光学窗口(650-900 nm)内利用穿透深度高、光损伤小的低能量长波长光子对细胞内稳定的偶氮键进行选择性裂解仍是一项巨大的挑战。
针对上述挑战,该团队受自然界中天然光酶(DNA光裂合酶)修复受损伤DNA机制的启发,即FADH通过吸收并累积多个光子能量打断稳定的C-C键的光催化方式,利用常见的有机红光光敏剂亚甲基蓝(MB)或其衍生分子新亚甲基蓝(NMB)作为光催化剂,实现了溶液相及乏氧细胞环境下的红光激发光催化偶氮键裂解及前药激活,图1。研究人员发现红光催化剂MB或NMB具有和天然光酶催化单元类似的氧化还原结构。并且NMB在被第一个红光光子激发后被还原,再经歧化反应可形成一个闭壳层两电子还原态(LNMB),LNMB可进一步与偶氮底物形成一个具有红光吸收的电荷转移复合物,在655nm红光激发下,以NADH作为电子给体,NMB对三种FDA批准市售的偶氮前药以及一种偶氮前药荧光探针(SA-Azo-C)均表现出可观的光催化激活效率。
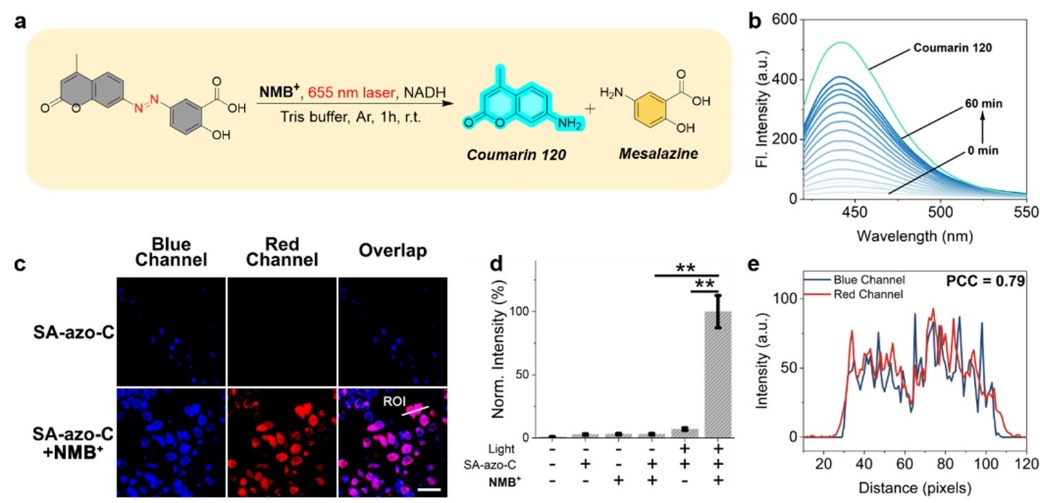
图2. 溶液相及乏氧细胞内红光催化偶氮前药激活及荧光示踪。图片来源:J. Am. Chem. Soc.
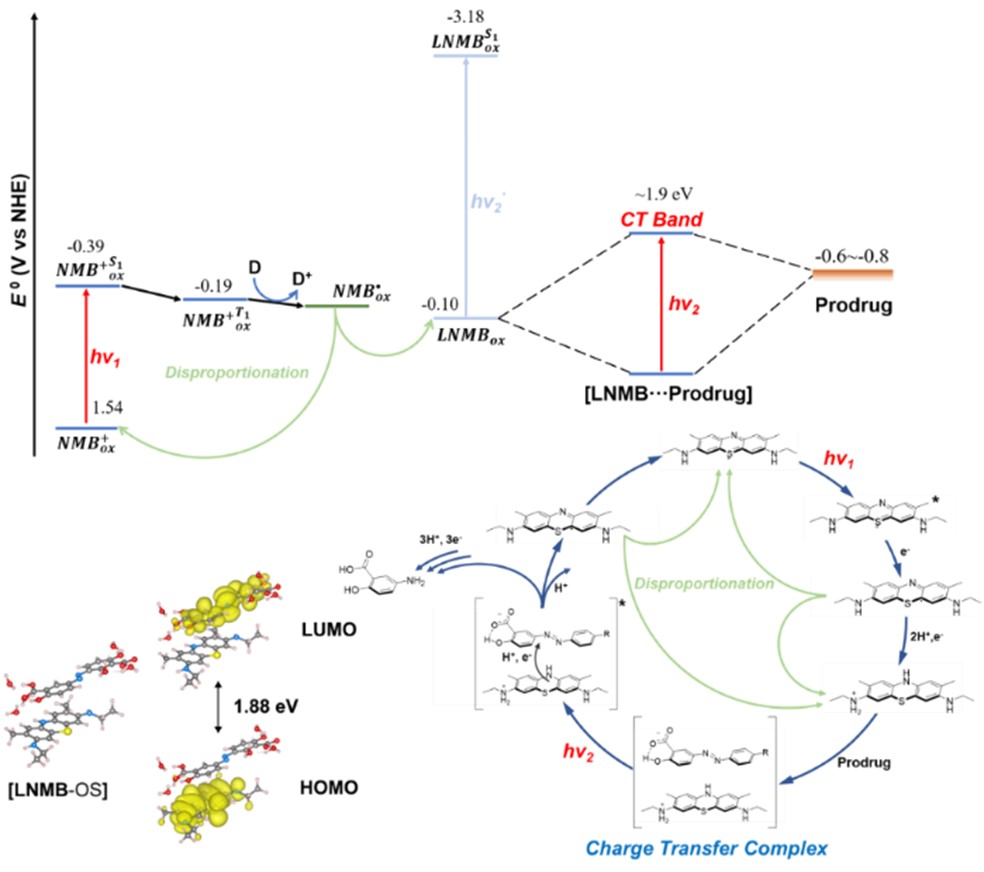
图3. 基于电荷转移复合物的连续红光催化偶氮键裂解机理及能级图。图片来源:J. Am. Chem. Soc.
SA-azo-C的细胞内光催化断键共聚焦荧光成像结果表明,该体系也成功应用于乏氧细胞内的红光生物正交偶氮前药激活,图2。DFT结果证实LNMB可与偶氮底物形成一个电荷转移复合物,与实验观测的吸收光谱结果保持一致,图3。纳秒瞬态吸收光谱进一步证实该红光吸收电荷转移复合物的再次光激发诱导了电荷转移复合物内的氧化还原反应,为逐次红光光子激发诱导电子转移引发偶氮键断裂的机理提供了直接的实验证据。该研究不仅在化学生物领域成功应用逐次光致电子转移机制(Consecutive Photoinduced Electron Transfer, ConPET)实现细胞内的低能光子光催化反应,也为光催化生物正交断键反应提供了一类新型的工具。
全文链接:https://pubs.acs.org/doi/10.1021/jacs.3c09837





