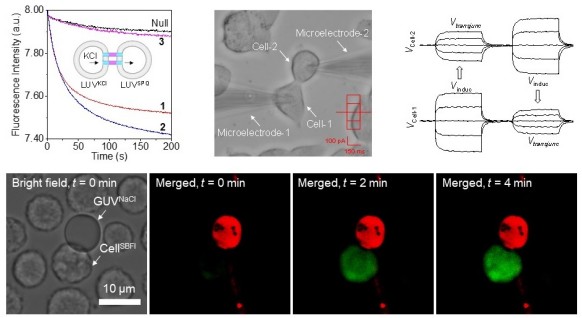
随着基因技术和合成生物学技术的快速发展,人工合成细胞已成为现实,为人工合成组织,甚至人工合成生命提供了可能。在生物体内,细胞不仅可以与其周围环境进行细胞内外的物质和信号输送,而且还可以与相邻细胞进行细胞间的物质和信号传递,从而维持同一组织内细胞环境的稳定及功能的一致性。由于正常细胞间存在着4-20 nm的间隙,因此,物质和信号无法直接在相邻细胞间进行传递。经过长期的进化,生物体发展了一种被称为间隙连接通道 (Gap Junctional channel) 的蛋白,这类蛋白可以将相邻的细胞连接起来,形成跨细胞间隙的通道,从而介导细胞间物质和信号的传递。在体外,这类蛋白的规模化制备以及与细胞膜的整合还存在很大的挑战性,从而限制了它们在人工合成细胞方面的应用。
化学系侯军利课题组通过学习生物体,采用“自下而上”的策略,结合共价合成与非共价组装,从头设计、合成了人工间隙连接通道,仿生了天然通道蛋白的结构与功能。相比于天然通道蛋白,这类人工通道具有合成简单,可自发嵌入细胞膜的特点。在活细胞中,这类人工间隙连接通道展现出了优异的细胞间信号传递和物质输送性能,表现出了良好的生物活性,不仅为人工合成细胞,甚至人工合成生命提供了新模块和新途径,而且还为发展新型的药物分子提供了新策略 (Nature Chem.,2024, DOI: 10.1038/s41557-024-01519-8)。
该工作为化学系18级直博生傅永鸿经过了研究生和博士后阶段的连续工作完成,并得到了课题组胡逸飞、林涛、庄国伟、王樱岚等同学以及陈文学老师和黎占亭老师的协助。该工作得到了科技部重点研发项目、国家基金委、上海市科委和复旦大学的经费资助。
全文链接:https://www.nature.com/articles/s41557-024-01519-8